新型コロナウイルス感染症が重症化するメカニズムを日本の研究チームが解明、免疫細胞の異常接着が原因か
国立国際医療研究センターの植木紘史主任研究員と同センター並びに東京大学国際高等研究所新世代感染症センターの河岡義裕センター長/機構長らの研究グループが、新型コロナウイルス感染症(COVID-19)が重症化するメカニズムを解明したと発表しました。
Neutrophil adhesion to vessel walls impairs pulmonary circulation in COVID-19 pathology | Nature Communications
https://www.nature.com/articles/s41467-024-55272-0
免疫細胞が引き起こすCOVID-19の重症化機序を解明 | 東京大学
https://www.u-tokyo.ac.jp/focus/ja/press/z0406_00022.html
研究チームは7つの異なる基礎疾患モデルマウスに、マウス順化型の新型コロナウイルス(SARS-CoV-2)を感染させ、感染後の生存率を評価しました。その結果、肥満・糖尿病モデル(Ob/Ob)マウスが野生型マウスと比較して生存率が著しく低いことが判明しました。
また、感染2日後の時点では、野生型マウスとOb/Obマウスの両方の肺と鼻甲介で大量のウイルスが検出されましたが、感染5日後ではOb/Obマウスの肺でのウイルス量が野生型と比較して優位に高かったとのこと。
マイクロCT解析を行ったところ、感染したOb/ObマウスではCOVID-19肺炎に類似する不均一で境界不明瞭な肺炎像が確認されました。また、病理組織学的解析では、Ob/Obマウスの肺胞領域に好中球や単核球などの炎症性細胞の浸潤が確認され、肺胞および細気管支上皮細胞にウイルス抗原が検出されました。これらの結果から、感染したOb/ObマウスはCOVID-19重症化の病態を反映していると研究チームは論じています。
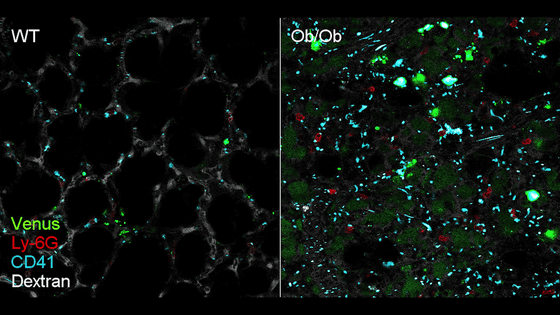
そして、研究チームは蛍光レポーター遺伝子を組み込んだマウス順化型SARS-CoV-2を作製し、Ob/Obマウスの感染細胞を可視化。さらに、蛍光標識デキストランと蛍光標識抗体を静脈内投与することで、肺血管や好中球、血小板を可視化しました。これにより、従来の解析では捉えることができなかった動的な現象を観察することができるようになったとのこと。
以下は左が野生型マウス、右がOb/Obマウスの肺を、2光子顕微鏡で観察したところ。Venus(緑)が感染細胞で、Ly-6G(赤)が好中球、CD41(青)が血小板、Dextran(白)が肺血管をそれぞれ可視化したもの。
研究チームによれば、SARS-CoV-2感染肺では、50µm/秒以下の「遅い移動」をする好中球の割合が増加し、50µm/秒より速い「速い移動」をする好中球の割合が減少したとのこと。
加えて、感染肺では8.57µm2未満の血小板の割合が減少し、凝集した血小板(8.57~34.28µm2)や血栓(34.28µm2以上)の割合が増加したとのこと。このことから、血小板が好中球と相互作用して微小血栓を形成することが判明しました。
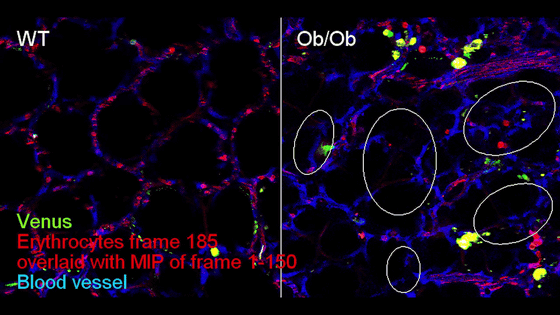
また、蛍光標識赤血球を用いた観察により、感染肺では肺血流が著しく阻害されていることが確認されました。以下はマウスの肺血流を観測したところで、野生型マウス(左)では血管構造と赤血球(赤)の流れる経路がほぼ一致していますが、感染マウス(右)では多くの血管(青)で赤血球が通過しない領域が存在しました。
そして、感染マウスの肺血管内の好中球では、CD62L(L-セレクチン)や(PDFファイル)CD44、E-セレクチンなどの接着分子の発現が増加していました。接着分子とは細胞同士をくっつける役割を担う分子のことです。
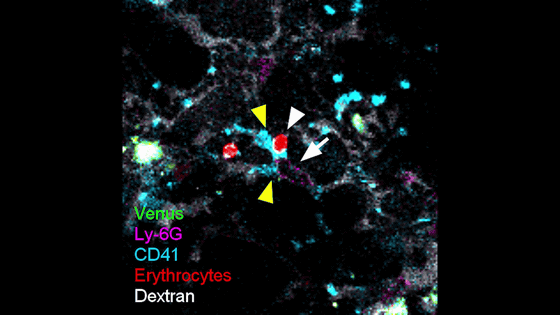
以下は感染したOb/Obマウスの血管を観察したもので、黄色い三角は凝集した血小板(CD41・青)、白い三角は停滞した赤血球(Erythrocytes・赤)、白い矢印は血管壁に接着した好中球(Ly-6G・紫)を示しています。好中球の血管壁への接着によって、血小板の凝集と血流の障害が引き起こされているのがわかります。
研究チームは、今回の発見は人間のCOVID-19重症化患者の血液サンプル分析結果とも一致していると述べ、好中球の血管壁への異常接着とそれに続く血小板凝集による微小血栓の形成が肺血流を阻害し、COVID-19肺炎を重症化させている可能性を指摘しました。この発見は、従来の病理組織学的解析や組織化学的解析では捉えることができなかったSARS-CoV-2感染症の新たな病態メカニズムを示すものです。
ただし、SARS-CoV-2に感染すると接着分子が増加する理由については完全に解明されていません。研究チームは、免疫細胞が他の細胞分泌するシグナル分子である炎症性サイトカインへの応答としてCD44の発現が増加した可能性や、SARS-CoV-2感染により骨髄での好中球の増殖が促進されることで未熟な好中球が大量に動員された可能性などを示唆していますが、接着分子の増加メカニズムの完全解明にはさらなる研究が必要だとしています。
本研究で解明されたCOVID-19重症化メカニズムの知見は、重症COVID-19患者や後遺症患者に対する新たな治療法の開発につながることが期待されます。特に好中球の異常接着と血小板凝集を標的とした治療アプローチは、重症患者や後遺症に苦しむ患者の治療に新たな選択肢を提供する可能性があると研究チームは述べました。
・関連記事
すべての新型コロナウイルス変異株を防御できる可能性のある抗体「SC27」が発見される、新型コロナの万能ワクチン開発に光 - GIGAZINE
下水から見つかった新型コロナウイルスの「謎の変異株」の発生起源を突き止める研究 - GIGAZINE
新型コロナウイルスに感染した回数が多いほどロングCOVIDのリスクは高くなる - GIGAZINE
新型コロナウイルス感染後の後遺症「ロングCOVID」の発症リスクを約1.6倍に高める遺伝子が発見される - GIGAZINE
新型コロナウイルス感染後の後遺症「ロングCOVID」で免疫システムが変化してしまう可能性 - GIGAZINE
・関連コンテンツ
in サイエンス, Posted by log1i_yk
You can read the machine translated English article Japanese research team uncovers mechanis….