低温電子顕微鏡法の性能を大幅に向上させる画期的な技術が登場、タンパク質の立体構造解明に光

20種類以上のアミノ酸が連結した鎖状の高分子化合物であるタンパク質は、人間の体内で行われるほぼ全ての機能に関わっており、タンパク質の構造を調べることは薬の開発や病気の治療法やメカニズムを研究する上で非常に重要となります。2020年5月、複数の研究チームが透過型電子顕微鏡法の一種である「低温電子顕微鏡法」という手法を改良し、タンパク質を構成する原子を識別可能なレベルまで分解能を向上させることに成功したと報告しています。
Breaking the next Cryo-EM resolution barrier – Atomic resolution determination of proteins! | bioRxiv
https://www.biorxiv.org/content/10.1101/2020.05.21.106740v1
Single-particle cryo-EM at atomic resolution | bioRxiv
https://www.biorxiv.org/content/10.1101/2020.05.22.110189v1
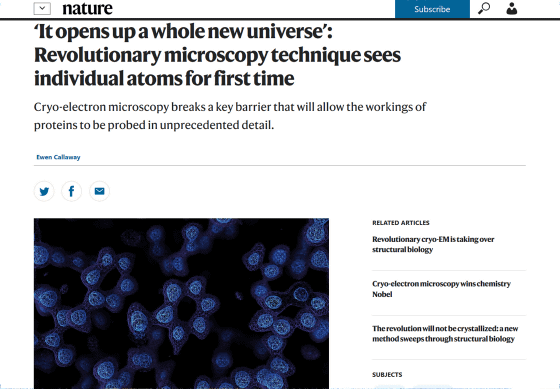
‘It opens up a whole new universe’: Revolutionary microscopy technique sees individual atoms for first time
https://www.nature.com/articles/d41586-020-01658-1
体内では多くのタンパク質が相互に関わることでさまざまな機能を果たしており、タンパク質は病気の原因となったり薬の標的となったりします。しかし、タンパク質を構成するアミノ酸残基がどのように連結しているのかはDNAに記されているものの、これはあくまでも一次元的な配列情報に過ぎません。タンパク質が持つ生体機能はその三次元的な分子構造によって左右されるため、タンパク質の立体構造を観察して特定する低温電子顕微鏡法や核磁気共鳴、X線結晶構造解析といった技術は非常に重要です。
低温電子顕微鏡法は試料を低温で凍結することで固定し、解析を行うことにより、試料を染色や化学固定で作成する通常の電子顕微鏡法と比較して、より生体内に近い試料の構造を観察できると考えられています。また、試料への電子線や高真空状態による損傷を避けられるというメリットもあるとのこと。
2013年ごろから、電子を検出する技術と画像解析ソフトウェアの発達によって、低温電子顕微鏡法の「解像度革命」が促進されています。この進歩により、低温電子顕微鏡法はX線結晶構造解析とほぼ同等の精度でタンパク質の構造を観察できるそうです。それでも、これまで低温電子顕微鏡法では原子レベルでの分解能で構造解析をすることはできず、タンパク質の構造を原子分解能で把握するには、依然として旧来のX線結晶構造解析に頼らざるを得ませんでした。
ところが、X線結晶構造解析に必要なタンパク質を結晶化させるプロセスには数カ月~数年かかることもあるだけでなく、医学的に重要なタンパク質の多くはX線結晶構造解析に使用できる結晶を形成しません。その一方で、低温電子顕微鏡法はタンパク質が精製された溶液中にあれば分析可能なため、原子分解能が達成できれば研究がよりスムーズに進むと見られています。

2020年5月、2つの独立した研究チームが低温電子顕微鏡法の分解能を向上させる手法を発表し、タンパク質を構成する原子を識別可能な「原子分解能」を達成したと報告しました。2つの研究チームは低温電子顕微鏡法の性能を原子分解能まで引き上げるため、鉄結合性タンパク質の一種であるアポフェリチンというタンパク質をターゲットに研究を行ったとのこと。
マックスプランク生物物理化学研究所のHolger Stark氏が率いた一方の研究では、試料に到達する電子の速度を一定に保つ機器を用いることで解像度を向上させ、原子分解能に匹敵する1.25オングストロームの分解能を達成しました。
また、MRC分子生物学研究所のSjors Scheres氏とRadu Aricescu氏が率いたもう一方の研究では、電子の速度を保つ別の技術を使用した上で、電子が試料から離れた後のノイズを軽減する技術と、より高感度な電子検出カメラを用いることで、1.2オングストロームの分解能を達成しました。1.2オングストロームという分解能は、タンパク質やその周囲の水分子から、水素原子を識別可能なほどの分解能だとScheres氏は述べています。
Scheres氏らの研究チームは、全身麻酔や抗不安薬といった多くの薬物の標的になるGABAA受容体というタンパク質の、簡略化された形状についてもテストを行いました。研究チームは新たな手法を用いることで、GABAA受容体でも1.7オングストロームの分解能が達成され、原子分解能こそ達成できなかったものの、これまで知ることができなかった詳細について知ることができたとのこと。

低温電子顕微鏡法の専門家である東京大学のDanev Radostin氏は、「マックスプランク研究所とMRC分子生物学研究所のグループが実に驚異的なレベルのパフォーマンスを発揮していることに、誰もが非常に興奮し、驚いています」とコメント。トロント大学のJohn Rubinstein教授も、「真の『原子分解能』は、本当のマイルストーンです」と述べました。
Scheres氏は今回の研究結果が、タンパク質構造を研究する主要なツールとしての低温電子顕微鏡法の地位を固める可能性が高いと主張していますが、Stark氏はX線結晶構造解析には固有のメリットがあると指摘。目的のタンパク質が大きく、結晶化できるとわかっている場合、潜在的な薬物と結合した状態のタンパク質構造を特定しやすいとのこと。「それぞれの手法には、まだ長所と短所があります」とコメントしました。
・関連記事
タンパク質の立体構造を予測するシステムが機械学習によって大きく進歩している - GIGAZINE
GoogleがAIでタンパク質の結晶を発見するシステムを開発、新薬開発のブレイクスルーに期待 - GIGAZINE
人工知能企業のDeepMindがタンパク質の立体構造を予測する「AlphaFold」を開発 - GIGAZINE
「バーチャル薬理学」で既存の創薬プロセスを劇的に加速させ未知の薬も同定可能に - GIGAZINE
新型コロナウイルスの治療法開発を自分のPCで手助けできる「Folding@home」が新たに低分子スクリーニングプロジェクトを開始 - GIGAZINE
電子顕微鏡の分解能が0.39オングストロームに到達し世界記録が更新される - GIGAZINE
・関連コンテンツ
in サイエンス, Posted by log1h_ik
You can read the machine translated English article Introducing an epoch-making technology t….