スタンドアロンの新型コロナウイルス感染症用在宅検査キットがFDAから初の認可を取得

医療品関連スタートアップのEverlywellが開発を進めていた自宅で使用可能なスタンドアロンの新型コロナウイルス感染症(COVID-19)用検査キットが、世界で初めてアメリカ国内の医療品を規制するアメリカ食品医薬品局(FDA)の認可を取得しました。
Coronavirus (COVID-19) Update: FDA Authorizes First Standalone At-Home Sample Collection Kit That Can Be Used With Certain Authorized Tests | FDA
https://www.fda.gov/news-events/press-announcements/coronavirus-covid-19-update-fda-authorizes-first-standalone-home-sample-collection-kit-can-be-used
Our commitment to fighting COVID-19 - Everlywell: Home Health Testing Made Easy - Results You Can Understand
https://www.everlywell.com/blog/news-and-info/our-commitment-to-fighting-covid-19/
Everlywell gains first FDA authorization for a standalone, at-home, COVID-19 test sample collection kit | TechCrunch
https://techcrunch.com/2020/05/16/everylwell-gains-first-fda-authorization-for-a-standalone-at-home-covid-19-test-sample-collection-kit/
Everlywellは現地時間の2020年5月16日に、新型コロナウイルス感染症を診断するための自宅で使用可能な検査キット「COVID-19 Test Home Collection Kit」が、FDAのEmergency Use Authorization(EUA:緊急時使用許可)を取得したことを発表しました。Everlywellの在宅検査キットは2020年5月後半から提供開始される予定。
「COVID-19 Test Home Collection Kit」で採用された検査方式は鼻咽頭スワブで、ユーザー自身が綿棒を使って鼻の奥から採取したサンプルをCLIA認定を受けた2つの研究所に送付する必要がありますが、研究所がサンプルを受け取ってから24~48時間以内に診断結果がオンライン上でチェック可能となります。
FDAはEverlywellの在宅検査キットにEUAを発行したことに合わせて、診断結果を出す2つのCLIA認定研究所で行われる新型コロナウイルス感染症の診断テストも承認したとしており、「検査キットおよび診断テストには個別にEUAによる認可が出ています」と説明しています。なお、検査キットで収集されたサンプルを診断するのはFulgent TherapeuticsとAssurance Scientific Laboratoriesという2つのCLIA認定研究所です

Everlywellの在宅検査キットはFDAからEUAを発行された初のスタンドアロン在宅診断プロセスです。他の検査キットを用いた診断プロセスの場合、指定の医師などの協力機関にサンプルを診断してもらう必要がありますが、Everlywellの在宅検査キットの場合は複数の協力機関である研究所にサンプルを診断してもらうことが可能です。また、協力機関のすべてがEAUを取得しているというのも特徴です。つまり、Everlywellの在宅検査キットを用いれば「外部機関に依存せずに単独で機能する診断プロセス」を受けられるため、これまでの検査キットよりも安定して幅広く診断プロセスを提供することが可能となります。
FDAのジェフリー・シュレン医学博士は「複数の研究所で複数の検査に使用できる新型コロナウイルス感染症用の在宅検査キットが認可を得たことは、患者がより手軽に検査を受けられるようになるだけでなく、非感染者を潜在的な曝露から保護することにもつながるはずです」と語っています。
Everlywellによれば、「FDAのEUAがEverlywellのようなデジタル医療品メーカーに発行されることは初めてのこと」だそうです。なお、Everlywellはこれまで新型コロナウイルス感染症の自宅検査キットでEUAを取得するためにFDAと協力してきただけでなく、臨床現場で使用するための新型コロナウイルス感染症用の検査キットを3万点ほど提供してきたとしています。
なお、Everlywellの在宅検査キット「COVID-19 Test Home Collection Kit」が発表されたのは、2020年3月23日のこと。Everlywellは「2020年3月18日時点で、アメリカの複数の研究所と協力してインフラストラクチャを拡張することで、毎週25万人分の検査キットを提供できるようにすることを計画しています」と述べていました。
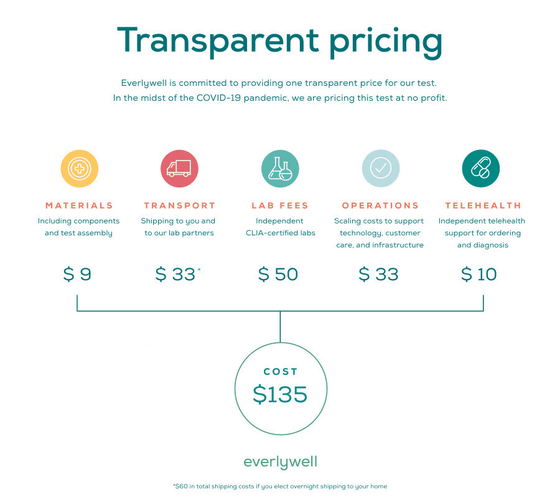
「COVID-19 Test Home Collection Kit」の価格は135ドル(約1万4000円)ですが、Everlywellは「当社にとって利益はない」としているため、原価に違い価格での検査キットの提供となる模様。135ドルの内訳は以下の通りで、検査キットの材料が9ドル(約1000円)、検査キットをユーザーの自宅に配送し、収集したサンプルを研究所に配送するのにかかる費用が33ドル(約3500円)、サンプルを診断するCLIA認定研究所に支払う手数料が50ドル(約5400円)、テクノロジーのサポートやカスタマーケア、インフラ整備といった在宅検査キットの操業にかかるコストが33ドル(約3500円)、テレヘルス関連の費用が10ドル(約1100円)です。
・関連記事
正確なPCR検査には「検査のタイミング」と「検査の種類」が重要 - GIGAZINE
「新型コロナウイルス抗体検査のお粗末さは災害レベル」と大手製薬会社のCEOが酷評、抗体検査の一体何が問題なのか? - GIGAZINE
新型コロナウイルス感染症の検査能力を「待機状態の検査機器」を使って大幅に引き上げる新たな手法が登場 - GIGAZINE
45分で新型コロナウイルス感染症を診断できる検査キットがアメリカで承認される - GIGAZINE
新型コロナウイルス感染症の「自宅で使える検査キット」がついにアメリカ政府の承認を受ける - GIGAZINE
・関連コンテンツ